5.1 Fenómenos fotoquímicos
La fotoquímica es el estudio de las transformaciones químicas provocadas o catalizadas por la emisión o absorción de luz visible o radiación ultravioleta. Una molécula en su estado fundamental (no excitada) puede absorber un quantum de energía lumínica, esto produce una transición electrónica y la molécula pasa a un estado de mayor energía o estado excitado. Una molécula excitada es más reactiva que una molécula en su estado fundamental.
El fenómeno fotoquímico precisa de fases principales:1. Recepción de la energía luminosa
2. Reacción química propiamente dicha.
Según se opere con una sustancia única o con un sistema de varios cuerpos en presencia, se realizará, bien una descomposición de la sustancia en sus elementos (fotólisis), bien una combinación de varios cuerpos en uno solo (fotosíntesis).
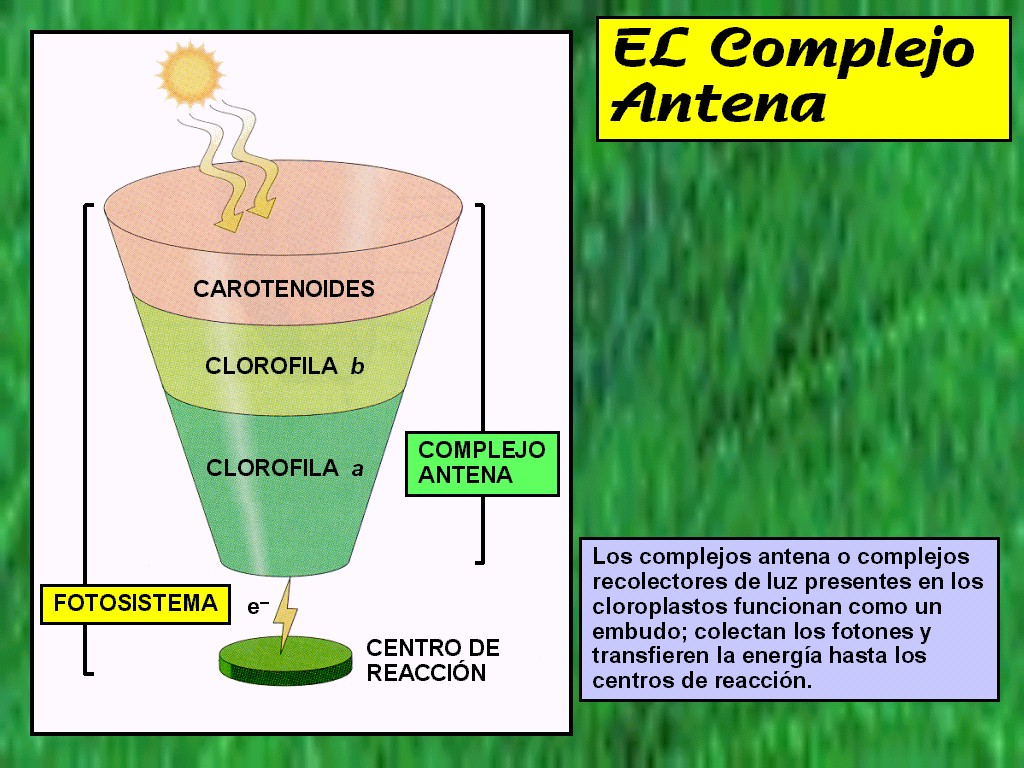
los pigmentos antena sirven para captar la luz, no inician ninguna reacción en la mayoría de los casos. En las plantas fotosintéticas los principales pigmentos son la clorofila a y b, y las xantofilas en menor cantidad.
El pigmento capta la luz dependiendo de la longitud de onda de cada uno, después la energía en forma de fotones produce un cambio de conformación del pigmento, después se ioniza y se obtiene un electrón en forma de energía.
Los pigmentos de los organismos fotosintéticos son la clorofila a y b, xantofilas, carotenoides, ficobilinas entre otros. Pero los pigmentos están presentes en todo el entorno, por ejemplo, el pigmento que nos permite ver a color es la rodopsina.
5.3 Cadena de transporte de electrones fotosintéticos
5.4 Análisis comparativo y evolutivo de la respiración y la fotosíntesis

La fotosíntesis y respiración son procesos íntimamente relacionados, producto de la fotosíntesis, que necesita de luz solar, dióxido de carbono y agua,liberando oxígeno a la atmósfera. La fotosíntesis es el mecanismo que tienen las plantas para producir energía química a partir de la luz del Sol, para su funcionamiento y para almacenamiento en forma de carbohidratos.
La respiración toma y consume este oxígeno liberando dióxido de carbono (y además agua). El oxígeno es necesario en los seres vivos aeróbicos para la respiración celular, y como un subproducto de este metabolismo de energía es que se desecha el CO2 (dióxido de carbono)
Ambos procesos son parte de un ciclo necesario para la vida de plantas y animales, donde se complementan mutuamente. Se puede decir que ambos procesos son parte de una relación dinámica, macroecológica.
La respiración toma y consume este oxígeno liberando dióxido de carbono (y además agua). El oxígeno es necesario en los seres vivos aeróbicos para la respiración celular, y como un subproducto de este metabolismo de energía es que se desecha el CO2 (dióxido de carbono)
Ambos procesos son parte de un ciclo necesario para la vida de plantas y animales, donde se complementan mutuamente. Se puede decir que ambos procesos son parte de una relación dinámica, macroecológica.